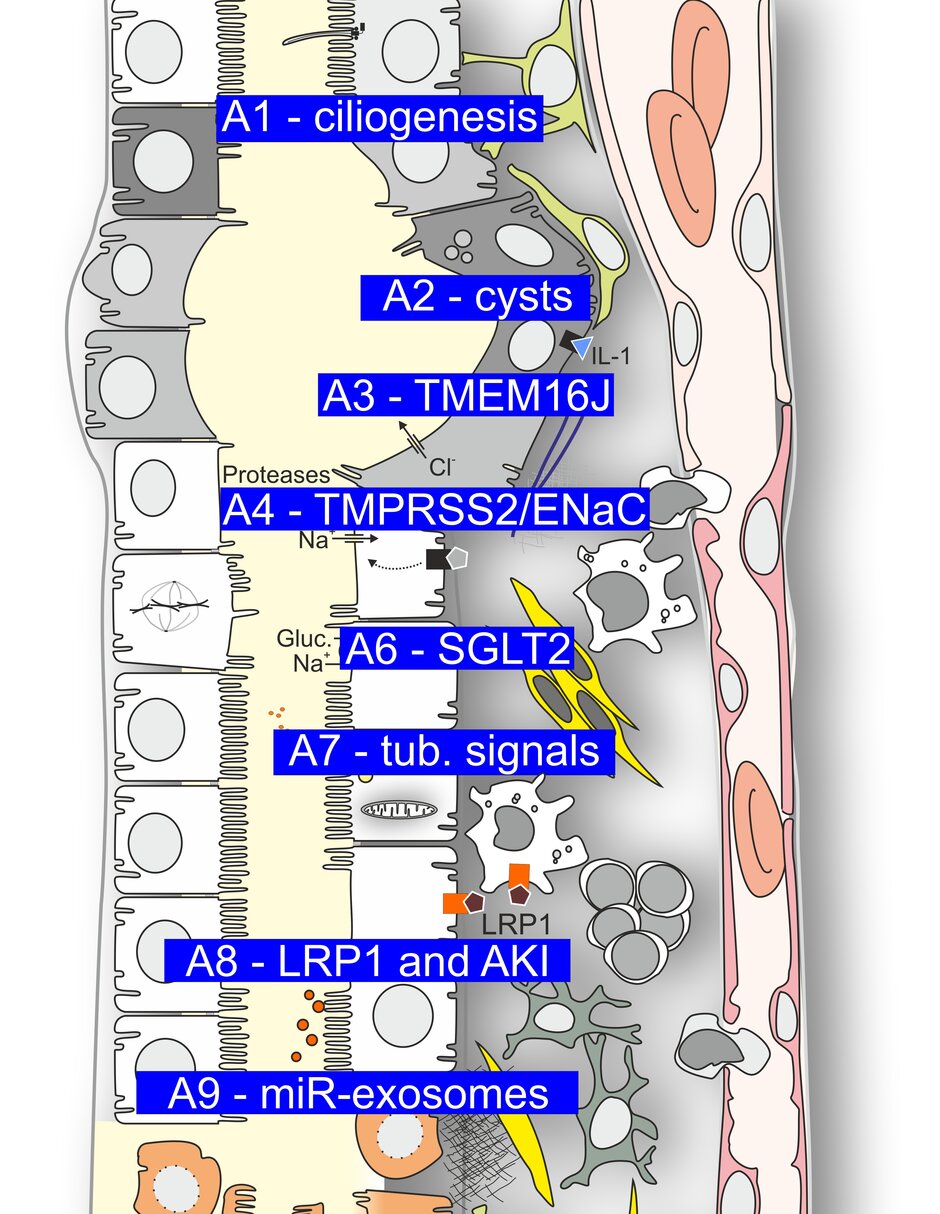
(Patho-)Physiologie des tubulären Systems
Der Forschungsbereich A hat zwei Schwerpunkte:
i) die Mechanismen der Ziliogenese und Zystogenese und
ii) transportassoziierte (Patho-)Physiologie und tubuläre Signalwege bei (Mal-)Adaptation.
Projekt A1
Mechanismen der frühen Ziliogenese
Prof. Dr. Ralph Witzgall (externer Link, öffnet neues Fenster), Molekulare und Zelluläre Anatomie, Universität Regensburg
Primäre Zilien haben eine eingeschränkte Funktion bei einer ständig wachsenden Zahl von Erkrankungen, die heute als Ziliopathien bezeichnet werden. Die zugrunde liegenden pathogenetischen Prozesse können nur verstanden werden, wenn die Bildung primärer Zilien umfassend charakterisiert wird. Nach Erkenntnissen aus der laufenden Förderperiode sind Endozytose und der Golgi-Apparat für die Ziliogenese wichtig. Im aktuellen Antrag wollen wir untersuchen, in welcher Weise endozytotische Prozesse zur Bildung von Zilien beitragen, wann der Golgi-Apparat beteiligt ist, welche Proteine am Golgi-Apparat aktiv sind und welche Proteine das Andocken und die Fusion von Transportvesikeln am Mutterzentriol erleichtern.
Projekt A2
Der Einfluss von ROS, Ferroptose, Glukosetransport und des IL-1-Rezeptorsignalwegs auf das Fortschreiten der ADPKD
Prof. Dr. Björn Buchholz (externer Link, öffnet neues Fenster), Physiologie, Universität Regensburg
In der vergangenen Förderperiode haben wir die durch HIF-1α induzierte und durch den Chloridkanal Anoctamin 1 vermittelte Calcium-aktivierte Chloridsekretion als einen wesentlichen Faktor für das Zystenwachstum bei polyzystischer Nierenerkrankung identifiziert. In dieser Förderperiode werden wir den Einfluss von HIF-induzierten, aber sekretionsunabhängigen Signalwegen auf die Zystenprogression in vitro und in vivo durch Hemmung des GLUT1-vermittelten Glukosetransports, Einsatz zugelassener HIF-PHD-Inhibitoren, Antagonisierung der IL-1-Rezeptorsignalgebung, Anwendung des Antioxidans Coenzym Q10 und Hemmung der Ferroptose untersuchen.
Projekt A3
TMEM16J bei chronischer Nierenerkrankung
Prof. Dr. Rainer Schreiber (externer Link, öffnet neues Fenster), Physiologie, Universität Regensburg
Prof. Dr. Karl Kunzelmann, Physiologie, Universität Regensburg
Während der aktuellen Förderphase hat eine genomweite Assoziationsstudie (Projekt C6) einen Zusammenhang zwischen den Proteinen TMEM16J und SIGIRR und chronischer Nierenerkrankung (CKD) nachgewiesen. Frühere Arbeiten unseres Teams haben gezeigt, dass TMEM16J ein intrazelluläres Protein ist, das die intrazelluläre Ca2+-Signalübertragung hemmt, die zahlreiche Zellfunktionen wie Volumenregulation, Zelltod und Proliferation beeinflusst. TMEM16J kontrolliert mit Hilfe von SIGIRR und PKP3 auch Entzündungen in verschiedenen Geweben. Wir haben festgestellt, dass TMEM16J in der Niere exprimiert wird, und werden seine Nierenfunktion und Rolle bei CKD untersuchen. Zu diesem Zweck untersuchen wir die Expression, Funktion und Rolle von TMEM16J in Mausmodellen für CKD unter Verwendung von TMEM16J-Knockout- und Knockin-Mäusen sowie Nieren von CKD-Patienten.
Projekt A4
Renale ENaC-Regulierung durch die transmembrane Serinprotease TMPRSS2 und strukturbasierte Analyse der proteolytischen Kanalaktivierung
Prof. Dr. Christoph Korbmacher (externer Link, öffnet neues Fenster), Physiologie, Friedrich-Alexander-Universität Erlangen-Nürnberg
PD Dr. Alexandr Ilyaskin (externer Link, öffnet neues Fenster), Physiologie, Friedrich-Alexander-Universität Erlangen-Nürnberg
Kürzlich haben wir TMPRSS2 als neuen Protease-Kandidaten identifiziert, der den epithelialen Natriumkanal (ENaC) durch proteolytische Spaltung aktiviert. Wir wollen die Rolle von TMPRSS2 bei der renalen ENaC-Regulation aufklären und weitere Einblicke in die komplexen molekularen Mechanismen der proteolytischen und nicht-proteolytischen ENaC-Aktivierung gewinnen. Ein besseres Verständnis der ENaC-Funktion auf molekularer Ebene könnte zu neuen (patho-)physiologischen und therapeutischen Konzepten für Nierenerkrankungen führen, die mit einer erhöhten ENaC-Aktivität und einer Salzretention in den Nieren einhergehen.
Projekt A6
Kardio- und nephroprotektive Mechanismen der SGLT2-Hemmung
Prof. Dr. Lars Maier (externer Link, öffnet neues Fenster), Kardiologie, Universität Regensburg
Prof. Dr. Stefan Wagner (externer Link, öffnet neues Fenster), Kardiologie, Universität Regensburg
Dr. Philipp Tauber (externer Link, öffnet neues Fenster), Physiologie, Universität Regensburg
SGLT2-Inhibitoren (SGLT2i) haben erhebliche positive Auswirkungen auf die Nieren- und Herzfunktion, aber die zugrunde liegenden Mechanismen sind unbekannt. Wir werden die Rolle von kardialen Na+-Kanälen für die SGLT2i-abhängige Hemmung von Herzschäden untersuchen, sowie den Einfluss der durch SGLT2i verbesserten Ejektionsfraktion auf den Nierenschutz bei Mäusen mit Herzinsuffizienz, die durch eine transversale Aortenkonstriktion induziert wurde. Darüber hinaus werden wir molekulare Mechanismen der SGLT2i-induzierten Mikroalbuminurie und des renalen Myo-Inositol-Verlustes identifizieren und die Folgen dieser Signalwege für die Herzfunktion bei Mäusen und Patienten mit Herzinsuffizienz untersuchen. Die Ergebnisse werden Aufschluss über neue Mediatoren und Mechanismen der kardiorenalen Wechselwirkung unter SGLT2i geben.
Projekt A7
Proximale tubuläre Signale als Determinanten für Nierenentzündung und Fibrose
Prof. Dr. Richard Warth (externer Link, öffnet neues Fenster), Medizinische Zellbiologie, Universität Regensburg
Prof. Dr. Christine Ziegler (externer Link, öffnet neues Fenster), Strukturbiologie, Universität Regensburg
In den letzten Jahren haben wir die Pathophysiologie von GATM- und EHD1-assoziierten monogenetischen Erkrankungen untersucht, die jeweils die proximalen tubulären Mitochondrien und die intrazelluläre Vesikeldynamik betreffen. Hier werden wir die Rolle von EHD1 bei der intrazellulären Membranformung und -dynamik sowie die adaptiven Mechanismen untersuchen, die dem milden Phänotyp von GATM-Knockin-Mäusen zugrunde liegen. Die erwarteten Ergebnisse werden dazu beitragen, die funktionellen Prinzipien der Anpassung und Fehlanpassung des proximalen Tubulus aufzuklären und idealerweise zur Entwicklung eines therapeutischen Ansatzes für das GATM-assoziierte Fanconi-Syndrom führen.
Projekt A8
Die Rolle des Lipoprotein-Rezeptor-verwandten Proteins 1 (LRP1) bei akuten Nierenverletzungen
Dr. Tilman Jobst-Schwan (externer Link, öffnet neues Fenster), Medizinische Klinik 4 – Nephrologie und Hypertensiologie, Universitätsklinikum Erlangen
Prof. Dr. Mario Schiffer (externer Link, öffnet neues Fenster), Medizinische Klinik 4 – Nephrologie und Hypertensiologie, Universitätsklinikum Erlangen
LRP1 ist ein ubiquitär exprimierter Membranrezeptor, der an der Wnt/β-Catenin-Signalübertragung und am Cholesterinstoffwechsel, aber auch an der Modulation von Immunzellen beteiligt ist. Diese Mechanismen sind alle an der Pathogenese der akuten Nierenverletzung (AKI) beteiligt. Unsere Vorversuche legen nahe, dass eine LRP1-Agonisierung ein plausibler nephroprotektiver Therapieansatz ist, der den veröffentlichten Daten zur Behandlung von Myokardinfarkten entspricht. Daher werden wir die Rolle von LRP1 bei AKI als experimentelle Grundlage für eine klinische Studie untersuchen.
Projekt A9
Aufklärung der glomerulären und tubulären Wechselwirkungen durch miR-haltige Exosomen
Prof. Dr. Janina Müller-Deile (externer Link, öffnet neues Fenster), Medizinische Klinik 4 – Nephrologie und Hypertensiologie, Universitätsklinikum Erlangen
Prof. Dr. Stefan Uderhardt (externer Link, öffnet neues Fenster), Medizinische Klinik 3 – Rheumatologie und Immunologie, Universitätsklinikum Erlangen
Die Mechanismen, die zu einer tubulären Beteiligung bei glomerulären Erkrankungen führen, sind noch unklar. Wir vermuten, dass bisher unbekannte interkompartimentale Kommunikationsnetzwerke zwischen glomerulären und tubulären Zellen über miRNA (miR)-beladene Exosomen existieren. Dies wird anhand von Zellkokulturen und transgenen Zebrafischlinien untersucht, die es uns ermöglichen, Exosomen in vitro und in vivo dynamisch zu verfolgen und die Auswirkungen auf die Autophagie, Entzündungskaskaden sowie die Geweberegeneration nach tubulären Verletzungen zu bestimmen. Als translationaler Ansatz werden miR-haltige Exosomen aus dem Urin von Patienten mit glomerulären Erkrankungen als potenzielle nicht-invasive Biomarker für tubuläre Verletzungen untersucht.